El sistema del complemento es un conjunto de proteínas plasmáticas y de membrana que desencadenan una serie de respuestas inmunitarias importantes, especialmente en la inflamación y en la defensa contra patógenos. Aunque clásicamente se ha considerado como parte del sistema inmunitario innato, estudios recientes destacan su papel como mediador central en la respuesta inflamatoria, influenciando tanto el sistema inmunitario innato como el adaptativo.
Las proteínas del complemento se activan en respuesta a una variedad de estímulos, incluyendo Daños Asociados a Patrones Moleculares (DAMP por sus siglas en inglés). Estos DAMP son moléculas liberadas o expuestas por células dañadas o en respuesta a estímulos infecciosos, lo cual indica la presencia de un peligro inminente para el tejido.
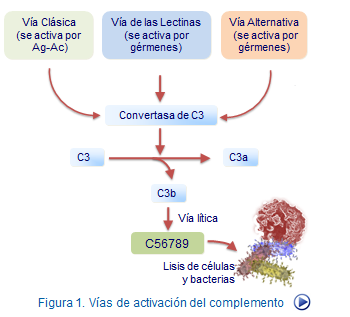
Existen tres vías principales de activación del complemento: la vía clásica, la vía de la lectina y la vía alternativa. Cada una de estas vías puede ser iniciada por diferentes estímulos y resulta en la activación de una cascada de proteínas que finalmente culmina en la formación de complejos proteicos que destruyen células marcadas o patógenos.
- La vía clásica se activa por la unión de anticuerpos a antígenos específicos en la superficie de las células o patógenos.
- La vía de la lectina se inicia cuando proteínas de tipo lectina reconocen y se unen a ciertos carbohidratos en la superficie de los microorganismos.
- La vía alternativa es iniciada por la interacción directa de proteínas del complemento con superficies microbianas o superficies celulares alteradas.
Una vez activadas, estas vías convergen en una serie de reacciones en cadena que incluyen la activación de proteasas, la formación de complejos proteicos de ataque a membranas (MAC) y la liberación de mediadores inflamatorios. Estos eventos no solo contribuyen a la eliminación directa de patógenos y células dañadas, sino que también modulan la respuesta inmunitaria mediante la liberación de moléculas señalizadoras que reclutan y activan células del sistema inmunitario, como macrófagos y células dendríticas.
La vía clásica del complemento se activa inicialmente por la formación de un complejo antígeno-anticuerpo mediado por IgM o IgG, que se une al componente C1q del complemento. Además de esta vía antígeno-anticuerpo, C1q también puede unirse a proteínas como la proteína C reactiva (CRP) o el amiloide P sérico, iniciando así la activación clásica en ausencia de anticuerpos específicos.
Una vez que C1q se une al complejo antígeno-anticuerpo o a las proteínas específicas, se produce la activación de otras proteínas del complejo C1, como C1r y C1s, formando el complejo C1qrs. Este complejo tiene la capacidad de escindir las proteínas del complemento C4 y C2 en fragmentos activos (C4b y C2a, respectivamente), lo que resulta en la formación de la C3 convertasa (complejo C4b2b). La C3 convertasa a su vez escinde la proteína C3 en C3a y C3b.
El C3b generado tiene múltiples funciones clave en la cascada del complemento. Se une covalentemente a superficies microbianas, células dañadas o complejos inmunes, marcándolos para la fagocitosis por células del sistema inmunitario o para la lisis directa. Además, C3b puede unirse al complejo C4b2b para formar la C5 convertasa (complejo C4b2b3b), que escinde la proteína C5 en fragmentos activos C5a y C5b.
El C5b es crucial para la formación del Complejo de Ataque a la Membrana (CAM). El CAM consta de C5b, C6, C7, C8 y múltiples unidades de C9 (C5b6789n), que se ensamblan en la membrana celular del patógeno o célula marcada. Esta estructura forma un poro en la membrana, conocido como poro de membrana terminal (PMT), que provoca la lisis celular por entrada descontrolada de agua y solutos.
En contraste, la vía alternativa del complemento se inicia de manera independiente de anticuerpos y depende de una hidrólisis espontánea basal de la proteína C3 en C3(H2O). El C3(H2O) puede unirse a superficies microbianas o células alteradas, reclutando al factor B. La unión de C3bB a C3(H2O) da lugar a la formación de la C3 convertasa alternativa (C3bBb), que escinde C3 en C3a y C3b de manera similar a la vía clásica y de la lectina.
Desde este punto, tanto la vía alternativa como la vía clásica/lectina convergen en la formación de la C5 convertasa y posteriormente en la producción del CAM, asegurando así la eliminación eficiente de patógenos y células dañadas.
Más de 30 mediadores diferentes han sido identificados en esta vía, cada uno con roles específicos que contribuyen a la función global del sistema del complemento. Independientemente de la vía de activación inicial (clásica, de la lectina o alternativa), el objetivo final del complemento es la formación del Complejo de Ataque a la Membrana (CAM).
El CAM, presente en dos formas principales, juega un papel crucial en la eliminación de células objetivo como bacterias, células infectadas por patógenos o células sometidas a estrés que exhiben señales de peligro. En su forma membranal, el CAM se inserta en la membrana de las células diana, provocando la formación de poros de membrana terminal que conducen a la lisis celular y la liberación del contenido intracelular, resultando en la destrucción de las células afectadas.
Por otro lado, el CAM soluble, conocido como sC5b-9, actúa como un potente mediador proinflamatorio. Además de su función directa en la muerte celular, los componentes del complemento también actúan como quimioatrayentes para células del sistema inmunitario, facilitando la migración de macrófagos, neutrófilos y otras células hacia el sitio de la lesión o infección.
Las proteínas del complemento son reconocidas por células presentadoras de antígeno (CPA), como los macrófagos, lo que promueve la fagocitosis de los complejos inmunes opsonizados. Además, el complemento regula la actividad de los linfocitos T y B, disminuyendo el umbral de activación necesario para iniciar una respuesta adaptativa eficaz contra patógenos.
A pesar de estos roles beneficiosos, es crucial mantener un equilibrio adecuado en la activación del complemento. Las células del huésped poseen proteínas reguladoras del complemento que previenen la activación no deseada contra las propias células. Sin embargo, en situaciones de daño celular masivo, como ocurre en la sepsis o los traumatismos, la liberación de Daños Asociados a Patrones Moleculares (DAMP) puede sobrepasar los mecanismos reguladores del complemento, desencadenando una hiperactivación.
Esta hiperactivación puede contribuir a la inflamación sistémica y la formación de coágulos observados en lesiones traumáticas graves. Por lo tanto, el sistema del complemento no solo es crucial para la inmunidad innata y adaptativa, sino que también desempeña un papel central en la respuesta inflamatoria y puede ser tanto protector como potencialmente dañino en contextos de patología severa.